UTILIDAD DE LOS ARRAYS EN EL DIAGNÓSTICO GENÉTICO
Un array CGH (Comparative Genomic Hybridization) es una técnica utilizada en el campo de la genética para detectar cambios en la estructura del ADN y en el número de copias de segmentos específicos del genoma. El array CGH ha demostrado ser una valiosa herramienta en la investigación y el diagnóstico genético, ya que permite una evaluación global y de alta resolución del genoma, proporcionando información importante para comprender las bases genéticas de las enfermedades y brindando apoyo a los médicos en la toma de decisiones clínicas.
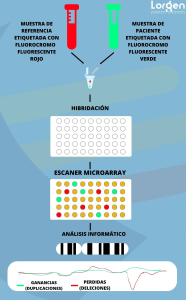
Procedimiento analítico del Array CGH en el laboratorio
A nivel técnico, el funcionamiento de un array CGH implica varios pasos clave:
Preparación de las muestras: Se obtienen las muestras de ADN de interés, como tejido tumoral, sangre u otros tipos de muestras biológicas. Estas muestras se extraen y se marcan con fluoróforos diferentes, por lo general, se utiliza un fluoróforo, como Cy3, para marcar la muestra de interés, y otro fluoróforo, como Cy5, para marcar la muestra de referencia normal. El marcado con fluoróforos permite detectar y distinguir las señales provenientes de cada una de las muestras durante el análisis posterior.
Hibridación: Las muestras marcadas se incuban en el array CGH, que contiene sondas genéticas específicas dispuestas en una matriz ordenada. Las sondas son secuencias de ADN complementarias a regiones específicas del genoma humano. Durante la hibridación, las sondas se unen a sus secuencias complementarias en las muestras de ADN.
Lavado: Después de la hibridación, se realiza un lavado cuidadoso para eliminar el exceso de ADN no unido y reducir el ruido de fondo. El lavado ayuda a mejorar la especificidad y la sensibilidad del proceso de hibridación, asegurando que solo las sondas que hayan formado uniones estables con las secuencias de ADN objetivo permanezcan en el array.
Escaneo: Después de la hibridación, se realiza un escaneo del array CGH para medir las señales de fluorescencia emitidas por las sondas genéticas que se han unido a las secuencias de ADN en las muestras de interés y la muestra de referencia normal.
Análisis de datos: Las señales de fluorescencia obtenidas durante el escaneo se cuantifican y se comparan entre la muestra de interés y la muestra de referencia normal. La diferencia en la intensidad de las señales entre las muestras indica los cambios en el número de copias de ADN en regiones específicas del genoma.
Interpretación de resultados: La interpretación de los resultados implica identificar las regiones del genoma donde se observan cambios en la intensidad de señal. Estas diferencias pueden indicar deleciones (pérdidas), duplicaciones (ganancias) o reordenamientos genómicos en la muestra de interés en comparación con la muestra de referencia normal.
Correlación clínica: Una vez que se identifican las alteraciones genómicas, se realiza una correlación clínica para determinar su significado. Esto implica asociar los cambios detectados con enfermedades genéticas conocidas, trastornos del desarrollo, predisposiciones a enfermedades o cualquier otra relevancia clínica.
Ventajas y limitaciones sobre el Array CGH
Los arrays CGH (Comparative Genomic Hybridization) ofrecen varias ventajas y algunas limitaciones en comparación con otras técnicas de análisis genético. Entre las ventajas señalamos las siguientes:
Análisis global: Los arrays CGH permiten analizar el genoma completo de manera global, lo que significa que se pueden detectar alteraciones en múltiples regiones del genoma simultáneamente. Esto facilita la detección de cambios cromosómicos complejos y proporciona una visión más completa de las alteraciones genómicas en comparación con otras técnicas más dirigidas.
Resolución alta: Es importante destacar que la resolución de un array CGH puede variar según el diseño específico del array y las sondas utilizadas. Algunos arrays CGH de alta resolución pueden tener una mayor densidad de sondas y cubrir regiones genómicas específicas de manera más detallada, lo que permite una mayor capacidad para identificar cambios en el número de copias de ADN en regiones pequeñas.
En un array CGH, cada sonda representa una ubicación específica en el genoma humano. Cuantas más sondas haya en el array, mayor será la resolución o detalle con el que se pueden detectar alteraciones genómicas. En el caso de un array con una resolución de 750 k, habrá 750,000 sondas distribuidas en diferentes regiones del genoma.
Eficiencia en el análisis de muestras: Los arrays CGH permiten analizar múltiples muestras en paralelo, lo que los hace eficientes en términos de tiempo y costo. Esto es especialmente beneficioso para estudios de investigación a gran escala o cuando se necesita analizar múltiples muestras clínicas en un entorno de diagnóstico.
Aunque los arrays CGH (Comparative Genomic Hybridization) son una técnica valiosa en el análisis genético, también tienen algunas limitaciones que es importante tener en cuenta, algunas de ellas son:
Resolución limitada en cambios a nivel de un solo nucleótido: Los arrays CGH están diseñados para detectar cambios en el número de copias de ADN en regiones genómicas, pero no pueden identificar cambios a nivel de un solo nucleótido, como mutaciones puntuales específicas. Para analizar mutaciones puntuales, se requieren técnicas de secuenciación de nueva generación (NGS) u otros enfoques más específicos.
No proporciona información sobre la secuencia de ADN: Aunque los arrays CGH pueden identificar alteraciones en el número de copias de ADN, no proporcionan información sobre la secuencia precisa de las regiones afectadas. Esto significa que no se pueden detectar cambios estructurales complejos, como inversiones o translocaciones equilibradas, que no afecten al número de copias.
Detección limitada de cambios en regiones altamente repetitivas: Las regiones altamente repetitivas del genoma pueden presentar desafíos para los arrays CGH. Las secuencias repetitivas pueden dificultar la asignación precisa de las señales a regiones específicas, lo que puede afectar la detección de alteraciones en esas regiones.
Sensibilidad a la calidad y cantidad de la muestra de ADN: Los resultados del array CGH pueden verse afectados por la calidad y cantidad de la muestra de ADN utilizada. Las muestras de baja calidad, con degradación o contaminación, pueden generar señales incorrectas o ruido de fondo, lo que dificulta la interpretación precisa de los resultados.
Requiere un análisis bioinformático complejo: El análisis de los datos generados por los arrays CGH requiere habilidades en bioinformática y experiencia en el análisis de datos genómicos. La interpretación adecuada de los resultados y la identificación de las alteraciones genómicas pueden requerir recursos y conocimientos adicionales.
Variabilidad técnica y normalización de datos: La variabilidad técnica, como diferencias en la eficiencia de la hibridación o en el rendimiento de las sondas, puede introducir ruido en los resultados. La normalización de los datos es necesaria para comparar muestras y reducir los efectos de la variabilidad técnica.
Por tanto, es importante considerar estas limitaciones al utilizar arrays CGH y complementarlos con otras técnicas, según sea necesario, para obtener una evaluación más completa y precisa de las alteraciones genómicas.
Aplicaciones en Medicina
Diagnóstico prenatal: Los arrays CGH se utilizan en el diagnóstico prenatal para detectar anomalías cromosómicas y genéticas en el feto. Esto permite identificar afecciones como el síndrome de Down, el síndrome de Turner, el síndrome de Patau y muchas otras. Comparado con las técnicas tradicionales, los arrays CGH pueden proporcionar una evaluación más completa del genoma fetal y una mayor resolución en la detección de alteraciones cromosómicas.
Diagnóstico postnatal de trastornos genéticos: Los arrays CGH se emplean en el diagnóstico de trastornos genéticos en individuos después del nacimiento. Pueden ayudar a identificar duplicaciones, deleciones y reordenamientos genómicos que pueden estar asociados con enfermedades genéticas, como son los trastornos del desarrollo, discapacidades intelectuales, trastornos del espectro autista, entre otros.
Cáncer: Los arrays CGH se utilizan en oncología para detectar alteraciones genómicas en muestras de tejido tumoral. Pueden revelar cambios en el número de copias de ADN en el genoma tumoral, proporcionando información sobre las ganancias o pérdidas genómicas que pueden estar asociadas con el desarrollo y progresión del cáncer. Esto ayuda a la clasificación de subtipos de cáncer, el pronóstico del paciente y la selección de terapias más adecuadas.
Genética del desarrollo y retraso del desarrollo: Como comentábamos anteriormente, los arrays CGH son útiles para investigar las bases genéticas de los trastornos del desarrollo y los retrasos en el desarrollo infantil. Pueden ayudar a identificar alteraciones genómicas que contribuyen a condiciones como el retraso del desarrollo global, el retraso del habla y el lenguaje, la discapacidad intelectual y los trastornos del espectro autista.
Farmacogenómica: Los arrays CGH también pueden tener aplicaciones en la farmacogenómica, el estudio de cómo la variabilidad genética influye en la respuesta de los individuos a los medicamentos. Al detectar alteraciones genómicas relevantes, los arrays CGH pueden ayudar a identificar pacientes que pueden tener respuestas atípicas a ciertos medicamentos o que podrían beneficiarse de terapias específicas basadas en su perfil genético.
En resumen, los arrays CGH seguirán evolucionando y desempeñarán un papel esencial en el diagnóstico genético y la medicina de precisión. Su capacidad para proporcionar una evaluación global del genoma y detectar alteraciones genéticas relevantes será fundamental para mejorar la comprensión de las enfermedades genéticas y el desarrollo de tratamientos personalizados y efectivos.
Dra. Carmen Entrala Bernal, Directora Técnica en Lorgen GP